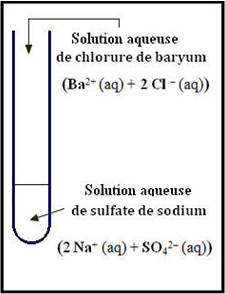
Le baryum est l’élément chimique de numéro atomique 5 de symbole Ba. Shannon, Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides , Acta Crystallogr. Il peut notamment réagir avec les ions sulfates en formant un précipité blanc de sulfate de baryuBaCl2(aq) + SO4(aq) → BaSO4(s) + Cl(aq).

Ion à caractériser Aspect initial ion réactif produit réactif observation ion sulfate. L’ion baryum Ba2+: c’est un cation monoatomique présentant un défaut de deux électrons. La structure électronique du dernier niveau d’énergie de l’atome du baryum (6s)permet la formation d’ions Ba2+ par perte des deux électrons (6s)et de 2 . On dose une solution de chlorure de baryum (BaCl2) de concentration C = mol.
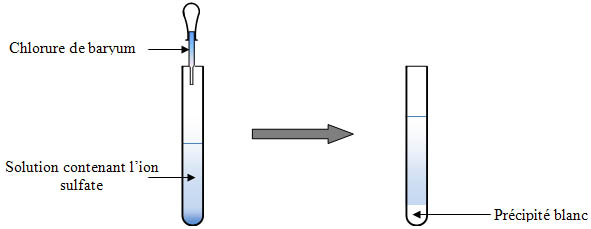
L-par une solution de sulfate de sodium Na2SOde concentration 1mol. Les ions Na+ et Cl- ne participent pas à la réaction. Teneur en sulfate d’une eau minérale – forum de.
Ion Baryum Ba2+, exercice de Chimie – 236429. Ions monoatomiques – Forum physique – chimie. Images correspondant à baryum ionSignaler des images inappropriéesMerci de vos commentaires et suggestions. Signaler une autre imageVous avez trouvé des images choquantes. On mélange V= 1mL de solution de sulfate de sodium baryum.
Quantité de matière initiale (mol) en ion baryum et sulfate : baryum11.