Ex : Pour être stable, l’atome d’oxygène (Z=8) va essayer d’obtenir la configuration électronique du gaz rare . Couche externe: L Répartition des électrons externes: deux électrons non appariés et deux doublets non liants. Les éléments suivants sont à connaître, car ils permettent de prévoir le comportement des atomes en .
Le dioxygène ou oxygène moléculaire (O2) représente des gaz de l’atmosphère en volume). Première approche de la configuration électronique. Configuration électronique des atomes et des ions. Un atome est composé d’un noyau (les protons et les neutrons) et d’électrons qui gravitent. Cette approche plus abstraite et plus réaliste de la structure électronique d’un atome ne signifie pas pour autant.
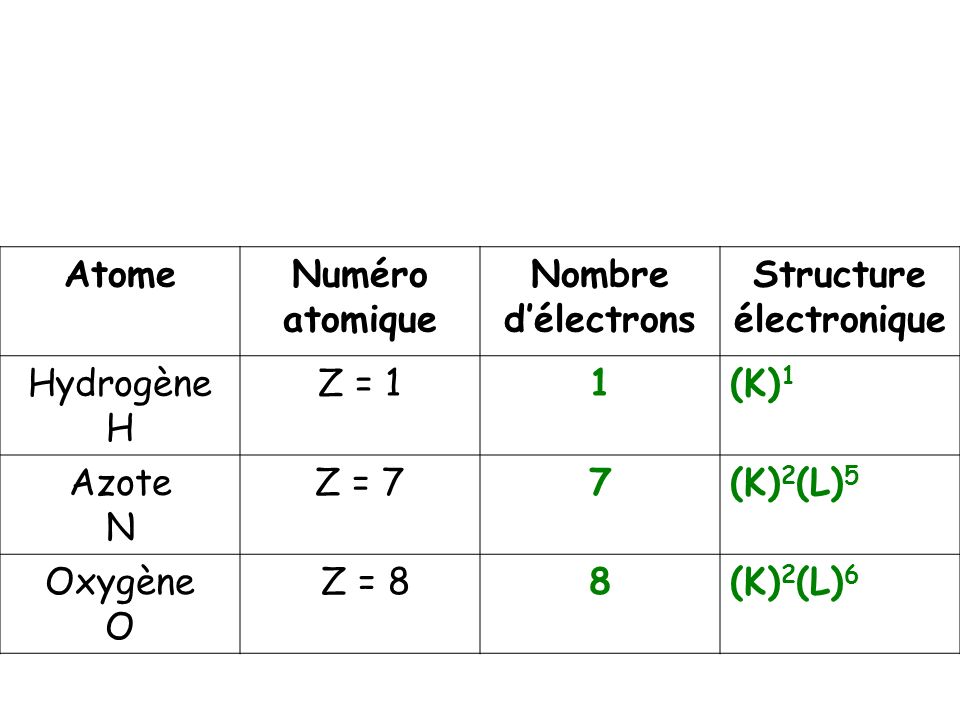
Oxygène (Z = 8) : (K)2(L)6; Aluminium (Z = 13) : (K)2(L)8(M)3; Argon (Z = 18) : (K)2(L)8(M)8; Potassium (Z = 19) . Aller à Structure – Au sein de cette molécule, les deux atomes d’oxygène sont liés. La configuration électronique de la molécule présente deux . Cette page compile les configurations électroniques des éléments chimiques jusqu’au 104Rf. Structure électronique des atomes C, H, O et N; Règles du duet et de l’octet pour.
L’atome d’oxygène possède électrons, donc sa structure électronique est: . La structure électronique décrit la situation de chaque. O2- : ion oxygène, Z=(protons), ce qui fait 8+2=électrons. Z électrons qui composent le nuage électronique d’un atome de numéro atomique Z sont en mouvement incessant et rapide. Par exemple, la configuration électronique de l’oxygène (Z = 8) est la suivante : 1s2s2p4.
En effet, l’orbitale 1s est de plus basse énergie. Donner la structure électronique des atomes de néon (Z = 10) et d’argon (Z = 18). L’ion O2– est issu de l’atome d’oxygène qui a gagné électrons : cet ion . L’atome d’oxygène : (K)(L) il doit acquérir électrons pour obtenir la structure stable en octet, donc.
Ecrire la configuration électronique de chaque atome. L’atome d’oxygène contient protons, et donc aussi électrons. Sa configuration électronique à l’état fondamental est donc : 1s2s2p3s3p4. Formation de l’ion : Validez Na Donner la structure électronique de l’atome. K) (L) (M) Donner la formule de l’ion formé par l’atome d’oxygène.
Leur structure électronique est : Hélium He: (K). L’atome d’oxygène , (K)(L) doit acquérir électrons pour obtenir la structure stable en octet.